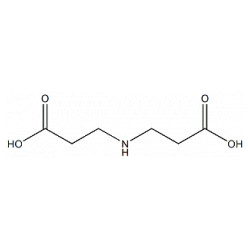
El iminodiacetonitrilo, llamado también 2,2'-iminobisacetonitrilo, 2,2'-iminodiacetonitrilo y 2,2'-azanodiildiacetonitrilo,[2][3] es un compuesto orgánico de fórmula molecular C4H5N3. Su estructura es lineal, con dos grupos carbonitrilo (-C≡N) en los extremos y un grupo amino secundario (-NH-) en el centro.
Propiedades físicas y químicas
A temperatura ambiente, el iminodiacetonitrilo es un sólido que tiene el aspecto de polvo cristalino de coloración beis. Su densidad es algo mayor que la del agua (1,1 g/cm³). Tiene su punto de fusión a 70 °C, mientras que su punto de ebullición es de aproximadamente 240 °C (valor estimado, no experimental).[2] Es soluble en agua, en proporción aproximada de 50 g/L,[4] siendo el valor del logaritmo de su coeficiente de reparto, logP = -0,88;[5] ello indica una solubilidad mayor en disolventes polares que en disolventes apolares como el 1-octanol.[2]
En cuanto a su reactividad, este aminonitrilo es incompatible con oxidantes fuertes.[4]
Síntesis y usos
Las primeras síntesis de iminodiacetonitrilo se llevaron a cabo haciendo reaccionar hexametilentetramina con cianuro de hidrógeno, pero los rendimientos eran muy pobres. Métodos posteriores conllevan la reacción entre aminoacetonitrilo y cianhidrina de formaldehído a una temperatura entre 50 °C y 150 °C, en ausencia de álcalis (tales como hidróxidos, carbonatos y cianuros de metales alcalinos o alcalinotérreos).[6] Del mismo modo, este dinitrilo puede obtenerse a también a partir de aminoacetonitrilo y glutaronitrilo con un rendimiento del 30%.[7]
Otra forma de síntesis consiste en añadir cianuro de hidrógeno y ácido sulfúrico a una suspensión de metilenaminoacetonitrilo en metanol. La mezcla se calienta a 60-75 °C y luego se deja enfriar a 0 °C para que precipite el iminodiacetonitrilo. Este método consigue un rendimiento del 52%.[8]
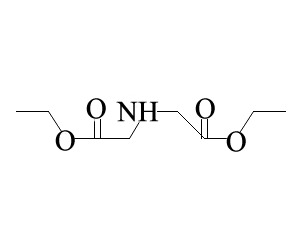
A su vez, el iminodiacetonitrilo se usa para sintetizar dietilentriamina (DETA), compuesto de interés en la química de coordinación; esta hidrogenación es catalizada por cobalto Raney en una atmósfera libre de oxígeno.[9] Igualmente ha sido utilizado producir ácido iminodiacético, intermediario en la elaboración de agentes quelantes, herbicidas y surfactantes. Se ha estudiado la acción biocatalítica por parte de la bacteria Alcaligenes faecalis, capaz de producir la enzima nitrilasa, alcanzando la conversión nitrilo → ácido el 65,3% en un medio «tamponado» con Na2HPO4-NaH2PO4 a pH 8,0.[10] También se ha empleado este dinitrilo como precursor de la metilglicina-N,N-ácido diacético (MGDA); este compuesto —y las sales derivadas del mismo— pueden sustituir al ácido etilendiaminotetraacético (EDTA) como agente quelante en detergentes y productos de limpieza.[11]
Se ha propuesto el uso del iminodiacetonitrilo para la fabricación de resinas quelantes, utilizadas en la purificación de aguas industriales, para tratamiento de aguas residuales y para recuperación de elementos metálicos valiosos.[12]
Precauciones
El iminodiacetonitrilo es una sustancia combustible cuyo punto de inflamabilidad es 158 °C (valor estimado)[2] y su temperatura de autoignición 480 °C. Es un compuesto tóxico si se ingiere, inhala o entra en contacto con la piel, pudiendo provocar irritación en los ojos.[4]
Véase también
Los siguientes compuestos son isómeros del iminodiacetonitrilo:
- Pirazinamina
- Aminopiridazina
Referencias